六、共价键参数
第四章 中曾讨论过共价键的概念,这里再讨论一下共价键的性质。
键长、键角、键能及键的极性等参数可以表征有机分子中共价键的某些性质。它们对探讨有机化合物的结构和性质是十分重要的。
(一)键长
在正常的、未激发的分子中,各原子处于平衡的位置。这时两个成键原子核中心间的距离就是该键的键长,一般用纳米(nm)表示。键长取决于成键的两个原子的大小及原子轨道重叠的程度。成键原子及成键的类型不同,其键长也不相同。例如,C-C、C=C及C≡C的键长分别是0.154、0.133和0.121nm,即单键最长,双键次之,三键最短。
(二)键角
分子中某一原子与另外两个原子形成的两个共价键在空间中的夹角,叫做键角。它的大小与分子的空间构型有关。例如,烷烃的碳原子都是sp3杂化的,所以H-C-C或H-C-H的键角都接近于109°28′;烯烃是平面型分子,碳是sp2杂化的,H-C-H或H-C-C的键角接近于120°;炔烃是线型分子,碳的杂化方式是sp,所以H-C-C的夹角为180°。
键角的大小是影响化合物性质的因素之一。例如环丙烷的C-C-C键角比正常的C-C-C键角小,因此它不太稳定。
(三)键能和键离解能
在25℃和101.325kPa下,以共价键结合的A、B两个原子在气态时使键断裂,分解为A和B两个原子(气态)时所消耗的能量叫做键能。一个共价键断裂所消耗的能量又叫做共价键的离解能。对于双原子分子来说,键能就等于离解能。键的离解能反映了以共价键结合的两个原子相互结合的牢固程度:键的离解能愈大,键愈牢固。但对多原子分子来说,键能和键离解能是两个不同的概念。多原子分子的离解能是指断裂一个给定的键时所消耗的能量,而键能则是断裂同类型共价键中的一个键所需要的平均能量。
表10-1列举了一些化合物的键的离解能。一般地说,它对我们较为有用。
表10-1 一些化合物的键离解能
| 键 | D/kJ·mol-1 | 键 | D/kJ·mol-1 |
| H-H | 435 | n-C3H7-H | 410 |
| H-F | 444 | t-C3H7-H | 397 |
| H-CL | 431 | t-C4H9-H | 381 |
| H-Br | 368 | CH2=CH-H | 435 |
| H-I | 397 | CH2=CHCH2-H | 368 |
| F-F | 159 | CH3-CH3 | 368 |
| CL-CL | 243 | C2H5-CH3 | 356 |
| Br-Br | 192 | n-C3H7-CH3 | 356 |
| I-I | 151 | i-C3H7-CH3 | 351 |
| CH3-H | 435 | t-C3H7-CH3 | 335 |
| CH3-F | 452 | CH2=CH-CH3 | 385 |
| CH3-CL | 351 | CH2=CHCH2-CH3 | 301 |
| CH3-Br | 293 | n-C3H7-CL | 343 |
| CH3-I | 234 | i-C3H7-CL | 339 |
| C2H5-H | 410 | t-C4H9-CL | 331 |
| C2H5-F | 444 | CH2=CH-CL | 351 |
| C2H5-CL | 343 | CH2=CHCH2-CL | 251 |
| C2H5-Br | 289 | ||
| C2H5-I | 226 |
(四)键的极性
由两个相同的原子或两个电负性相同的原子组成的共价键,由于它们的共用电子对的电子云对称地分布于两个原子核之间,所以这种共价键是非极性的。如果组成共价键的两个原子的电负性不同,则形成极性共价键。它们的共用电子对的电子云不是平均地分布在两个原子核之间,而是靠近电负性较大的原子,使它带部分负电荷(用δ-表示);电负性较小的原子则带部分正电荷(用δ+表示)。例如,氯甲烷,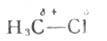
荷,碳带部分正电荷。两个键合原子的电负性相差愈大,键的极性愈强。
键的极性能导致分子的极性。用极性键结合的双原子分子是极性分子;用极性键结合的多原子分子是否有极性,则与分子的几何形状有关。
键的极性能够影响物质的物理性质和化学性质。它不仅与物质的熔点、沸点和溶解度有关,而且还能决定在这个键上能否发生化学反应或发生什么类型的反应,并影响与它相连的键的反应活性。