第二节 缓冲溶液
一、缓冲溶液与缓冲作用原理
(一)缓冲作用与缓冲溶液
纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸/强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。
(二)缓冲溶液的组成
缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。
1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。
2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。
3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。
(三)缓冲溶液的作用原理
现以HOAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH稳定的原理。醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HOAc分子形式存在,OAc-的浓度很低。醋酸钠是强电解质,在溶液中全部离解成Na+和OAc-,由于同离子效应,加入NaOAc后使HOAc离解平衡向左移动,使HOAc的离解度减小,[HOAc]增大。所以,在HOAc-NaOAc混合溶液中,存在着大量的HOAc和OAc-。其中HOAc主要来自共轭酸HOAc,OAc-主要来自NaOAc。这个溶液有一定的[H+],即有一定的PH值。
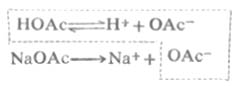
在HOAc-NaOAc缓冲溶液中,存在着如下的化学平衡:
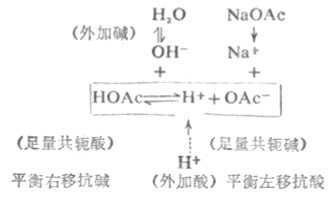
在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。假设不发生其他反应,溶液的PH值应该减小。但是由于[H+]增加,抗酸成分即共轭碱OAc-与增加的H+结合成HOAc,破坏了HOAc原有的离解平衡,使平衡左移即向生成共轭碱HOAc分子的方向移动,直至建立新的平衡。因为加入H+较少,溶液中OAc-浓度较大,所以加入的H+绝大部分转变成弱酸HOAc,因此溶液的PH值不发生明显的降低。
在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。假设不发生其他反应,溶液的PH值应该增大。但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HOAc原有的离解平衡,促使HOAc的离解平衡向右移动,即不断向生成H+和OAc-的方向移动 ,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。因为加入的OH-少,溶液中抗碱成分即共轭酸HOAc的浓度较大,因此溶液的PH值不发生明显升高。
在溶液稍加稀释时,其中[H+]虽然降低了,但[OAc-]同时降低了,同离子效应减弱,促使HOAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。所以,溶液具有抗酸、抗碱和抗稀释作用。
多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡:
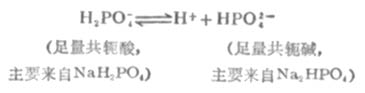
HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。
弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
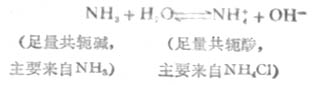
二、缓冲溶液PH的计算
(一)亨德森方程式
在缓冲溶液例如HOAc-NaOAc溶液中,有以下的离解平衡:
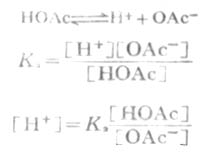
等式两边各取负对数,则

即 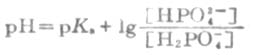
HOAc的离解度比较小,由于溶液中大量的OAc-对HOAc所产生的同离子效应,使HOAc的离解度变得更小。因此上式中的[HOAc]可以看作等于HOAc的总浓度[共轭酸](即缓冲溶液中共轭酸的浓度)。同时,在溶液中NaOAc全部离解,可以认为溶液中[OAc-]等于NaOAc的总浓度[共轭碱](即配制的缓冲溶液中共轭碱的浓度)。将[共轭酸]和[共轭碱]代入上式,则得
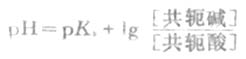
上式称为亨德森-哈塞尔巴赫方程式,简称为亨德森(Henderson)方程式。它表明缓冲溶液的
PH值决定于共轭酸的离解常数Ka和组成缓冲溶液的共轭碱与共轭酸浓度的比值。对于一定的共轭酸,PKa为定值,所以缓冲溶液的PH就决定于两者浓度的比值即缓冲比。当缓冲溶液加水稀释时,由于共轭碱和共轭酸的浓度受到同等程度的稀释,缓冲比是不变的;在一定的稀释度范围内,缓冲溶液的PH值实际上也几乎不变。
式(3-11)中的浓度项指的是混合溶液中共轭酸碱的浓度,而不是混合前的浓度.若混合前共轭酸的量浓度是c酸,体积是V酸,共轭碱的量浓度是c碱,体积是V碱,则式(3-11)可改写成:
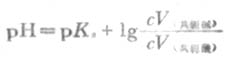
若两种溶液的量浓度相等,则
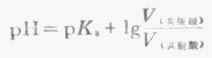
若是等体积的两溶液相混合,则
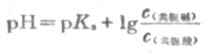
以上几种形式都称为亨德森方程式,可用以计算各种组成类型缓冲溶液的PH近似值。当用于弱酸及其对应的盐组成的缓冲溶液的PH值时,PKa即弱酸的离解常数负对数(见书后附表),[共轭碱]即[弱酸盐]。当用于多元弱酸的酸式盐及其对应的次级盐组成缓冲溶液的PH值时,共轭酸即酸式盐,pKa即该酸式盐负离子的离解常数的负对数,共轭碱即该酸式盐的次级盐。例如,NaHCO3-Na2CO3缓冲溶液的PH值:

式中PKa即H2CO3的PKa2。
同样,NaH2PO4-Na2HPO4缓冲溶液的PH值:
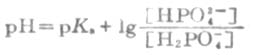
式中PKa为H3PO4的PKa2。
弱碱和它的共轭酸缓冲溶液的PH值也可根据式(3-11)计算。
(二)缓冲溶液PH值计算举例
例5 0.1mol.L-1的HOAc500mL与0.2mol.L-1的NaOAc250mL配成缓冲溶液,计算溶液的pH值。
解:把所给条件代入式(3-11),由书后附表查得HOAc的pKa=4.75,则得:

例6 将0.3mol.L-1HOAc溶液10mL与0.1mol.L-1NaOH溶液10mL混合后制成缓冲溶液,试计算这个溶液的pH值(2.5℃时,HOAc时pKa=4.75)。
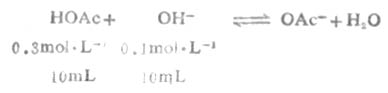
从反应看出HOAc有1/3被OH-中和,生成OAc-和H2O,溶液的总体积为20mL。
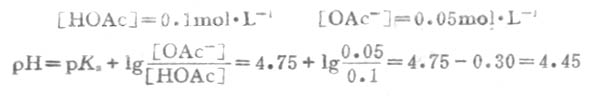
例7 H2PO2-4已知的pKa=7.21,求浓度为0.100mol.L-1、pH7.40的磷酸盐缓冲溶液的缓冲比以及共轭碱HPO2-4和共轭酸H2PO2-4的浓度。
解:设[H2PO2-4]为χmol.L-1,因缓冲溶液的总浓度(共轭酸浓度+共轭碱浓度)为已c=0.100mol.L-1,故[H2PO2-4]=(0.100-χ)mol.L-1
根据式(3-11)或式(3-14):
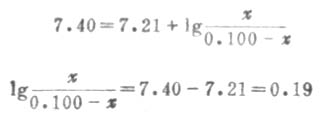
缓冲比为 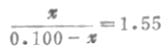
χ=0.061,[HPO2-4]=0.061mol.L-1
0.100- χ=0.100-0.061=0.039,[ H2PO2-4]=0.039mol.L-1
三、缓冲容量与缓冲范围
(一)缓冲容量
缓冲能力的强弱,可用缓冲容量β表示。缓冲容量也叫缓冲值或缓冲指数。
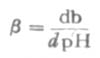
如图3-1所示,对任何一种缓冲溶液的每一个PH值,都有其相应的缓冲量。缓冲容量实际上是一个微分比,可定义为:使1升缓冲溶液的PH值增高很小一个数值dPH时,需加入的强碱物质的量为db,则db与dPH之比值叫缓冲容量,用数学式表示为β=db/dPH缓冲mol·L-1·PH-1。如总浓度(即共轭酸与共轭碱浓度之和)为0.100mol·L-1PH4.45的HOAc-NaOAc缓冲溶液(即醋酸缓冲溶液)的缓冲容量为0.051(mol·L-1·PH-1)。
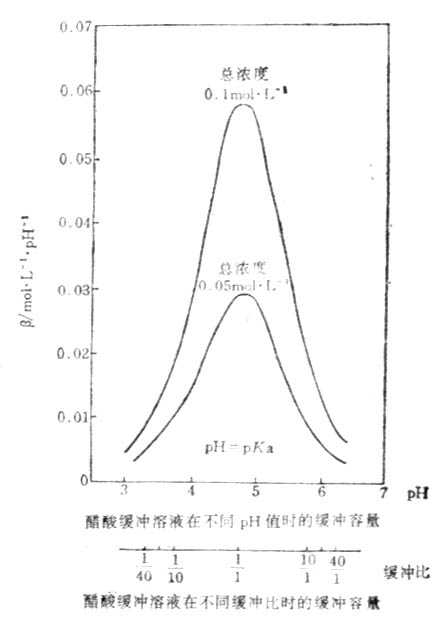
图3-1 醋酸缓冲溶液在不同缓冲比时的缓冲容量
在实际工作中,我们可以通过测量加入强碱的增量Δb(或加入强酸,相对于减少强碱量-Δb),同时测量相应的PH值的增量ΔPH(或加入强酸,PH减小,-ΔPH),从两者比值求得β。因此缓冲容量在数值上等于使1毫升缓冲溶液的PH值改变1个单位时所必须加入的强碱或强酸的物质的量(通常单位用毫摩)。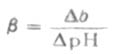
加入碱Δb以后,溶液PH值增大,加入酸以后(相当于减去Δb),溶液PH值减小,所以β总是正值。
(二)影响缓冲容量的因素
缓冲容量的大小与缓冲溶液的缓冲比和总浓度有关。设m和n分别为缓冲比中共轭酸和共轭碱的数值,即[共轭碱]:[共轭酸]=n:m,c总为总浓度,用下式可计算缓冲容量β:
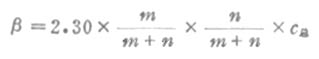
或β=2.30×[共轭酸]×[共轭碱]/ c总(3-18)
从式(3-18)及图3-1可以看出,缓冲溶液的缓冲容量取决于缓冲溶液的总浓度及缓冲比.可得出如下结论:
1.当缓冲溶液的缓冲比一定时,溶液的PH值也一定。缓冲溶液的缓冲容量取决于缓冲溶液的总浓度和缓冲比的比值。
2.当缓冲溶液的PH值一定时,即缓冲比垢比值一定时,缓冲溶液的总浓度越大,则加入少量强酸或强碱所引起缓冲比的比值变化越小,PH改变越小,缓冲容量就越大。图3-1表示两种总浓度都一定的醋酸缓冲溶液的β分别随缓冲比和PH改变的情况。总浓度为0.1mol·L-1和0.05 mol·L-1的醋酸缓冲溶液,当缓冲比为1:1时,PH为4.75,β分别为0.0575和0.0288(mol·L-1·PH-1),总浓度大的溶液缓冲容量较大。从式(3-18)也可见,当缓冲比一定即m和n的数值一定时,β与缓冲溶液的总浓度成正比。总浓度一般在0.05-0.20mol·L-1范围内。
3.当缓冲溶液的总浓度一定时,它的缓冲容量以缓冲比等于1(即[共轭碱]=[共轭酸])时为最大。这时溶液的PH=PKa。当溶液的缓冲比与1偏离愈远,则PH值与PKa的偏差也随着增大,溶液的缓冲容量也随着减小。当溶液的缓冲比大于10/1或小于1/10时,则溶液的缓冲容量极小,一般认为没有缓冲能力。从图3-1看出,对总浓度一定的缓冲溶液来说,当缓冲比愈接近于1:1,缓冲容量愈大;当缓冲比等于1:1,即缓冲溶液的PH值等于PKa时,缓冲容量达极大值(β极大)。当m=n=1,式(3-18)成为
β极大=2.30×1/2×1/2×β极大=0.575β极大 (3-19)
4.由足够浓度的共轭酸碱对组成的溶液,只能在一定的PH值范围内发挥有效的缓冲作用。这个能发挥有效缓冲作用的PH范围,叫缓冲范围。当缓冲比为1/10时,PH=PKa-1;当缓冲比为10/1时,PH=PKa+1。故缓冲范围PH值大致在PKa-1至PKa+1约两个PH单位范围内,即在
PH= PKa±1
的近似范围内,才能表现出缓冲作用。而且同一溶液在不同的PH值时,缓冲容量也不相同。从图3-1,缓冲超出此范围时,β值很小(<0.01),已无缓冲作用。
5.不同缓冲对所组成的缓冲溶液,由于共轭酸的PKa值不同,因此它们的缓冲范围也各不相同(表3-6)。
例8 将0.20mol.L-1NaOH溶液0.15mL加入10mLpH值为4.73的缓冲溶液中,缓站溶液的pH值变为4.78,试求此缓冲溶液的缓冲容量。
解:每毫升缓冲溶液中加入NaOH的毫摩尔数
△b=0.20*0.15/10
△pH=4.78-4.73
表3-6 几种常用缓冲溶液中共轭酸的PKa及缓冲范围
| 缓冲溶液的组成 | 共轭酸的PKa | 缓冲范围 |
| H2C8H4O4(邻苯二甲酸)-NaOH(即H2C8H4O-4-HC8H4O-4) | 2.89(PKa1) | 2.2~4.0 |
| KHC8H4O4( )- NaOH(邻苯二甲酸氢钾)(即HC8C4O-4-C8H4O2-4) | 5.41(PKa2) | 4.0~5.8 |
| HOAc- NaOH(即HOAc-OAc-) | 4.75 | 3.7~5.6 |
| KH2PO4-Na2HPO4 | 7.21(PKa2) | 5.8~8.0 |
| Htris+-Tris[三(羟甲基)氨基甲烷-HCL] | 8.21 | 7.1~8.9 |
| H3BO3- NaOH(即H3BO3-H2BO-3) | 9.14(PKa1) | 8.0~10.0 |
| NaHCO3-Na2CO3(即HCO-3-CO2-3) | 10.25(PKa2) | 9.2~11.0 |
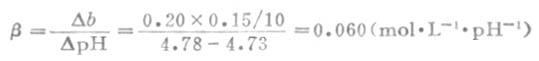
例9 (1)求0.100mol.L-1醋酸缓冲溶液的缓冲容量极大值;(2)已知醋酸的pK=4.75,求0.100mol.L-1pH4.45的醋酸缓冲溶液的缓冲容量。
解:(1)当缓冲溶液的缓冲比为1:1,即m=1和n=1时,缓冲容量达极大值。已知ca=0.100mol.L-1。则由式(3-19)
β极大=0.575c总=0.575*0.100=0.0575(mol.L-1.pH-1)
(2)根据式(3-11),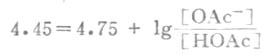

所以 缓冲比[OAc-]/[HOAc]=0.50/1
即 m-1 n=0.5
代入式(3-18)得
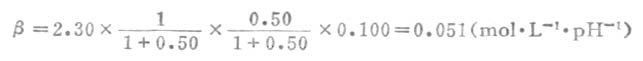
四、缓冲溶液的配制
在配制具有一定PH值的缓冲溶液时,为了使所得溶液具有较好的缓冲能力,应注意以下原则:
1.选择适当的缓冲对,使配制溶液的PH值在所选择的缓冲对的缓冲范围内。这个范围大约在PKa±1之内。例如HOAc-OAc-缓冲对的范围是3.7-5.6,要配制PH从3.7-5.6之间的缓冲溶液可选用这一缓冲对。
2.缓冲对中作为共轭酸的PKa,应尽量接近于配制溶液的PH值。例如,要配制PH为5.3的缓冲溶液时,可以选用HOAc-OAc=或HC8H4O4-C8H4O2-4缓冲对,因为pH5.3恰恰在这两种缓冲对的缓冲范围内。但是,前者的共轭酸的PKa 为4.75;后者共轭酸的PKa 为5.4,所以选用HC8H4O-4-C8H4O2-4配制的缓冲溶液较选用前者有更大的缓冲容量。
3.要有一定的总浓度(通常在0.05-0.20mol·L-1之间)使所配成溶液具有足够的缓冲容量,并采用适当的缓冲比使溶液的pH恰好等于所需要的PH值。
在具体配制时,为了简便起见,常用相同浓度的共轭酸碱溶液。此种情况可用式(3-13)计算所需两种溶液的体积。然后根据体积比,把共轭酸碱两种溶液混合,即得所需的缓冲溶液。设溶液的总体积是V总,则式(3-13)改写成
或
例10 如何配制100mLpH值为5.10的缓冲溶液?
解:根据配制缓冲溶液的原则,可选择HOAc-OAc-缓冲系来配制。因pH=5.10,pKa=4.75,V总=100L,故
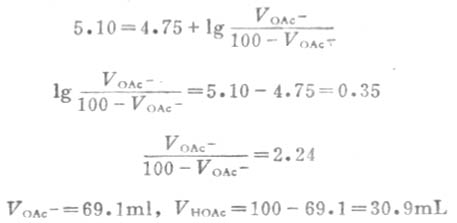
配制缓冲溶液还可采用共轭酸中加氢氧化钠或共轭碱中加盐酸的办法。两种方法都可组成有足够浓度的共轭酸碱对的缓冲溶液。
例11 欲配制pH值为5.10的缓冲溶液,计算在50mL的0.1ml.L-1HOAc溶液中应加0.1mol.L-1NaOH溶液多少mL?
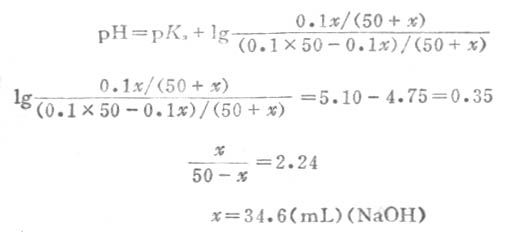
故χ=34.6(mL)(NaOH)
在50mL0.1mol.L-1HOAc溶液中加入34.6mL0.1mol.L-1NaOH溶液即得所需缓冲溶液。
应用亨德森方程式来配制缓冲溶液,没有考虑溶液的离子强度的影响。
一些缓冲溶液的配制法可查阅参考书或附录克拉克缓冲系列及碱性缓冲系列表,其准确度较高,表中的浓度及体积都要求准确。表中稀释值ΔPH1/2表示缓冲溶液用等体积水稀释后Ph 的变化。Tris缓冲系适合生理学和生物化学要求,比较常用。
五、缓冲溶液在医学上的意义
人体内各种体液的PH值具有十分重要的意义。它们均控制在一狭小范围内。因为只有在这范围内,机体的各种功能活动才能正常进行。离开正常范围的少许变化尚能允许,但如变化太大,都可能引起体内许多功能失调。
在体内差不多每项代谢的结果都有酸产生,如有机食物被完全氧化而产生碳酸,嘌呤被氧化而产生尿酸,碳水化合物的厌氧分解而产生乳酸以及因氧化作用不完全而导致乙酰乙酸和в-羟基丁酸的生成等。体内代谢也生成磷酸和硫酸。代谢过程也可以产生NaHCO3。这些代谢产生的酸或碱进入血液并没有引起PH值发生明显的变化,这说明血液具有足够的缓冲作用。也说明体内有着有效的生理作用支配着体内能及时地得到缓冲物的不断补充。
正常人血浆的PH值相当恒定。血液所以具有缓冲作用,是因为血液是一种很好的缓冲溶液。血液中存在下列缓冲系(HA表示有机酸):
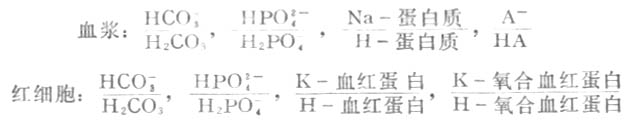
在这些缓冲系中,碳酸氢盐缓冲系(HCO-3/H2CO3)在血液中浓度很高,对维持血液正常PH值的作用很重要。其次红细胞中的血红蛋白和氧合血红蛋白缓冲系也很重要。这些缓冲系中的共轭酸(如H2CO3)起抗碱作用,共轭碱(如HCO-3)起抗酸作用,使PH值保持正常。
由于H2CO3-NaHCO3(或CO2-HCO-3)缓冲系在血浆中存在如下平衡:
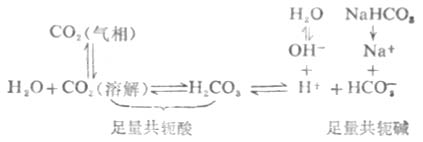
当人体内各组织和细胞在代谢中产生的酸进入血液时,血液中CO2-HCO-3缓冲系的共轭碱HCO-3就和H+反应,并转变为其共轭酸H2CO3及CO2,即上述H2CO3离解平衡向左移动。因碳酸仅轻度离解,所以,等于把加入的H+从溶液中有效地除去,维持PH基本不变。而溶解的CO2转变为气相CO2从肺部呼出。如果代谢产生的碱进入血液,则上述血液中的离解平衡向右移动,从而抑制PH值的升高。而血液中升高的[HCO-3]可通过肾脏功能的调节使其浓度降低。
血液中其他缓冲系的抗酸抗碱作用和CO2-HCO-3缓冲作用的原理相似。而且,当产生CO2过多时,主要是通过血红蛋白和氧合血红蛋白运送到肺部排出,或通过磷酸缓冲系使[CO2]降低。至于降低的[HCO-3]也可以通过肾脏功能的调节使其在血液中的浓度升高,从而使[CO2]、[HCO-3]和[HCO-3]/[CO2](溶解)都恢复正常。肺呼吸快些或慢些可调节CO2的量或酸量(呼吸慢则CO2积蓄);而肾的功能之一是调节血液中HCO-3的浓度及磷酸盐缓冲系的含量。肺和肾脏的协同调节操持[HCO-3]/[CO2](溶解)=20/1,虽然这时缓冲比超出(10/1)-(1/10)范围,可是缓冲容量仍然很大。总之,血液PH值能保持正常范围,是多种缓冲对的缓冲作用以及有效的生理调节作用的结果。
微生物的培养,组织切片和细菌染色,以及研究酶的催化,都需用一定PH值的缓冲溶液。在临床检验中,常把血液中HCO-3的浓度看作“碱储备”,作为一种常规来检查,也需要缓冲作用的知识。理解缓冲作用的基本原理和掌握这方面的基本实验知识,在医学上有重要的意义。